Química
Se denomina química (del árabe kēme (kem, كيمياء), que significa "tierra") a la ciencia que estudia la composición, estructura y propiedades de la materia, como los cambios que ésta experimenta durante las reacciones químicas y su relación con la energía. Históricamente la química moderna es la evolución de la alquimia tras la Revolución química (1733).


¿Que tan rapido funciona?
Reacciones químicas. Velocidad de las reacciones químicas. Catalizadores

Cuando reaccionan dos o más sustancias se producen nuevos materiales, lo cual ocurre en un tiempo determinado; todo depende de un conjunto de factores que influyen en la rapidez de reacción, tales como: naturaleza de los reaccionantes, división de los materiales reaccionantes, concentración, temperatura y la presencia de catalizadores. Todos estos factores hacen que unas reacciones sean más rápidas y otras más lentas: podemos determinar la rapidez con que reaccionan dos sustancias, tomando en cuenta la cantidad de sustancia transformada o producida en función del tiempo.
|
||||||||||||
|
||||||||||||
|
De acuerdo con la teoría atómica de la materia, los cambios químicos tienen explicación si se consideran como resultantes del reagrupamiento de átomos que originan nuevas moléculas. |
||||||||||||
|
||||||||||||
|
|
||||||||||||
|
Descomposición: |
||||||||||||
|
Desplazamiento: Un reactivo es una sustancia simple y reacciona con una sustancia compuesta la cual desaloja a uno de los componentes y ocupa su lugar en la correspondiente molécula; |
||||||||||||
|
|
||||||||||||
|
|
||||||||||||
|
||||||||||||
|
Para dar inicio a una reacción es necesario el suministro de energía, a ésta se le denomina Energía de Activación. La Teoría de las Colisiones considera que las partículas de las sustancias deben chocar en forma efectiva para poder reaccionar, para esto las partículas deben tener la debida orientación y chocar con suficiente energía hasta alcanzar la energía de activación, que las capacita para reaccionar entre sí. |
||||||||||||
|
||||||||||||
|
|
||||||||||||
|
||||||||||||
|
b) Presencia de un catalizador en una reacción : Un catalizador es una sustancia que modifica la rapidez de una reacción química sin que ella misma se consuma en el proceso o sufra algún cambio químico. Existen dos tipos de catalizadores: Catalizadores positivos: que aceleran la rapidez de una reacción. |
||||||||||||
|
|
||||||||||||
QUIMICA ORGANICA
De donde viene?
| El origen de la química orgánica |  |
 |

Sello en honor Berzelius
En 1823, Friedrich Wöhler, completó sus estudios de medicina en Alemania y viajó a Estocolmo para trabajar bajo la supervisión de Berzelius. 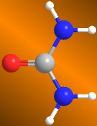
Urea.
El análisis de los mismos determinó que se trataba de urea. La transformación observada por Wöhler convierte un compuesto inorgánico, cianato de amonio, en un compuesto orgánico, la urea, aislada en la orina de los animales. Este experimento fue la confirmación experimental de que los compuestos orgánicos también pueden sintetizarse en el laboratorio |




